Le troisième Workshop portant sur la feuille de route pour la sortie de l’expérimentation animale pour les tests de sécurité des produits chimiques (produits industriels et médicaments) a été organisé par la Commission européenne (CE) et l’Agence européenne pour les produits chimiques (ECHA) à Helsinki et en visioconférence les 16 et 17 juin 2025.
Nous en proposons ici une synthèse.
Toutes les informations, les vidéos et les présentations sont disponibles sur la page de l’événement.
Pourquoi ce worshop ?
Ce workshop est le troisième du genre après ceux de décembre 2023 et d’octobre 2024. Par rapport aux deux précédents, il apporte des précisions sur le calendrier et la gouvernance.
Rappelons que ces travaux ont été initiés à la suite de l’Initiative Citoyenne Européenne (ICE) « Pour des cosmétiques sans cruauté – S’engager en faveur d’une Europe sans expérimentation animale » soumise à la Commission Européenne en janvier 2023 (1,2 million de signataires).
Cette feuille de route doit « indiquer le chemin pour accélérer le développement, la validation et l’implémentation des méthodes non-animales ».
Trois groupes de travail ont été mis en place :
- Santé humaine
- Sécurité environnementale
- Gestion du changement
Outre les nombreuses réunions de ces groupes, il s’est tenu 40 événements (conférences, séminaires…). Et 2 enquêtes en ligne ont été réalisées auprès des parties prenantes.
Que recouvre cette feuille de route ?
Il est prévu que la feuille de route fasse une quinzaine de pages, avec un document complet associé. Elle couvrira l’ensemble des législations européennes qui peuvent induire des tests animaux de sécurité, soit 15 législations différentes (Reach, biocides, pesticides, médicaments, dispositifs médicaux, produits vétérinaires, produits en contact avec l’alimentation, détergents…).
Les recommandations porteront sur les points suivants : le remplacement, la réduction et le raffinement des tests sur animaux à court et moyen terme ; les étapes pour la mise en œuvre ; la facilitation de la prise en compte des nouvelles méthodes dans les législations ; la mise en place d’un réseau efficace de validation/qualification des nouveaux tests ; le choix des indicateurs pour suivre la progression de l’implémentation ; le choix des structures organisationnelles appropriées.
A noter l’apparition de la nouvelle notion de « qualification », qui se rapproche de la notion de « validation » mais avec une procédure moins longue (sans l’étape de vérification de la reproductibilité inter-laboratoires). Cependant, avec cette procédure simplifiée, des produits pourraient se voir refuser l’entrée dans certains pays faute de reconnaissance internationale des tests non animaux.
Quelles sont les échéances ?
Le calendrier prévisionnel est le suivant :
- Entre juin et septembre 2025, intervient la phase de rédaction du projet de feuille de route, avec des échanges avec les parties prenantes.
- Entre septembre et décembre, doit intervenir l’approbation interne par la Commission et l’adoption de la feuille de route, qui doit être publiée pendant le 1er trimestre 2026, à la suite de quoi commencera la phase d’implémentation.
- Pendant la phase d’implémentation, interviendront les discussions sur les nouvelles technologies à développer pour opérer la transition.
Le cœur des travaux
Le modèle proposé est celui des « trois paniers », précisant ce qui est possible à court, moyen et long terme :
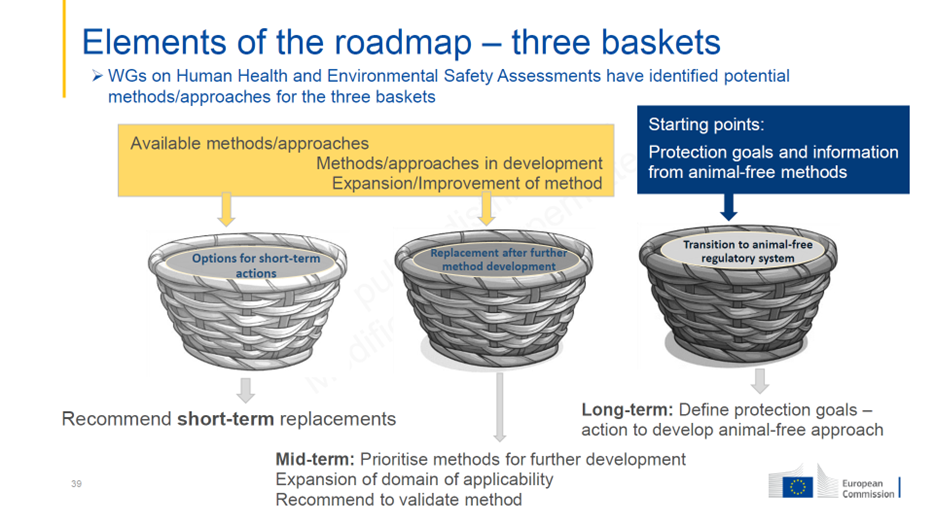
Cette approche est utile pour sortir du débat stérile entre ceux qui souhaitent remplacer tous les tests animaux par des NAMs (nouvelles approches méthodologiques) tout de suite et ceux qui défendent qu’on n’y arrivera jamais. Il s’agit de distinguer les méthodes utilisables à court terme et celles restant à mettre au point, à moyen ou long terme, dans les domaines complexes de la toxicologie, sachant que le remplacement « un pour un » n’est pas possible pour la plupart des tests. Une autre approche est nécessaire, résumée sous le terme de « Next Generation Risk Assessment » (NGRA) basée sur une batterie de tests in vitro et in silico.
La gouvernance
Plusieurs instances seront mises en place, les ONGs étant pleinement parties prenantes, avec les industriels, la CE et les agences européennes, les experts des méthodes non-animales. Un enjeu important de cette gouvernance est la collaboration entre l’ensemble des Agences européennes impliquées.
Considérant le nombre d’organismes et de partenaires impliqués dans ce processus, une coordination du travail s’avère indispensable qui permettra également de prendre en compte d’autres initiatives comme « OSOA » : « one substance, one assessment » et le projet de révision de la réglementation Reach sur les produits chimiques.
La feuille de route devrait préciser comment coordonner tous les organismes et instances. Ce rôle pourrait être tenu par l’EPAA (European Partnership for Alternative Approaches to Animal Testing).
Des indicateurs de succès de la feuille de route et de son implémentation seront mis en œuvre de façon transparente :
- Indicateurs liés à l’engagement, le partage des connaissances, la création de la confiance
- Indicateurs sur le développement et la validation des tests, leur financement, le rapport coût-efficacité, l’adoption par l’industrie, l’acceptation réglementaire
- Indicateurs sur les barrières à l’adoption, l’efficience et la fiabilité
- Indicateurs sur les 3Rs
Les problèmes posés et les attentes vis-à-vis des NAMs
Lors de la première enquête en ligne auprès des parties prenantes, fin 2024, parmi près de 200 répondants (industriels, ONGs, instituts de recherche, autorités et agences réglementaires…), 95% voyaient des avantages à développer la transition vers des tests sans animaux : diminution des délais pour accéder au marché, coût moins élevé, meilleure image de l’entreprise, produits plus sûrs, réduction de la charge administrative …
Mais des obstacles scientifiques subsistent ainsi que la barrière de l’acceptation réglementaire.
Ceci étant, les freins à la transition ne sont pas que techniques mais aussi socio-culturels. Il est important de créer de la confiance vis-à-vis des NAMs et de développer une confiance mutuelle entre industriels, scientifiques, administratifs et agences de régulation.
L’objectif est de parvenir à une approche centrée sur l’humain, sans tests animaux, adoptant une compréhension mécaniste de la toxicité (liens causaux entre exposition, altérations moléculaires, effets adverses), intégrant les besoins en matière de sécurité environnementale.
Parmi les perspectives de court terme, a été émise l’idée de supprimer l’obligation de tester certains produits sur une « seconde espèce », dans la perspective d’éviter des tests chez les chiens notamment.
La question du financement de la validation est apparue fondamentale ; elle constitue un goulot d’étranglement. Plusieurs pistes ont été évoquées comme la recherche de partenariats public/privé (voir l’exemple de la plateforme PEPPER). Il a également été suggéré qu’un montant dédié à la validation des tests non animaux soit prévu dans le montant alloué lors des appels à projets européens.
Parmi les parties prenantes, on constate une grande diversité d’attentes et de priorités. Pour les ONGs, l’important est de stopper l’utilisation d’animaux au plus vite. Pour les scientifiques, outre cet objectif, l’accent est mis sur l’amélioration des tests de sécurité pour la santé humaine et environnementale. Au vu des milliers de produits à tester dans l’avenir en fonction des exigences de sécurité, il sera de toute façon impossible de continuer avec les tests sur animaux. Il faut changer de méthodologie, comprendre le processus de toxicité (qui est différent chez les souris et les humains) et avoir une approche déterministe.
L’exemple de la transition déjà effectuée dans l’industrie cosmétique est évoqué afin de s’en inspirer. L’UE pourrait être moteur dans ce domaine des tests alternatifs mais les Etats-Unis sont déjà bien avancés. La nécessité de réaliser la transition à un niveau international a été soulignée.




